2015年01月18日
省エネ技術解説1;蒸留プロセスの設計について(本編2)
今年初めての投稿です。今年もよろしくお願いいたします。
さて、前回、蒸気、溶液の比熱について説明しましたが、蒸気に関して補足資料として飽和水蒸気表を紹介します。
この表、特に飽和蒸気表1をプロセスの計算でも使います。
飽和水蒸気表は水の各圧力における飽和温度、飽和蒸気の比エンタルピー、蒸発潜熱などが記載されており0℃の液体の状態を比エンタルピーの基準(0kcal/kg)としています。飽和水蒸気表1では0℃の値が記載されていませんが飽和水蒸気表2(出典 新版 化学工学 -解説と演習- (2000))では温度t=0℃のときの比エンタルピーが2502kJ/kg、蒸発潜熱が2502kJ/kgとあることから比エンタルピーから蒸発潜熱を差し引いた飽和液の比エンタルピーが0になっていることがわかります。また、表の単位が1と2で異なりますが1kcal=4.186kJとして換算すると同じような値になっていることが確認できます。また、圧力の単位kg/cm2≒atmとして問題ありません。


飽和水蒸気表1 飽和水蒸気表2
また、今回のプロセスの計算に必要なメタノール、水の各物性値を掲載します。

プロセスの設計ではまず、物質収支を考えます。物質収支とは物質の入量=出量という物質量保存則のことで、全物質収支と成分物質収支の式を立て、それらの連立方程式を解きます。
【仕様】1)で供給液①は濃度45wt%と供給量1000kg/hが設定され、2)で留出液⑥の濃度99wt%、3)で缶出液⑦の濃度1wt%という製品側の条件が設定されています。するとこれらの条件から留出液、缶出液の量が計算できます。(wt%は質量パーセント濃度)
メタノール水溶液の物質収支は留出液の量mD、缶出液の量mWとすると全物質収支は
1000=mD+mW
一方、メタノールの成分物質収支は水溶液のメタノール成分の量について考えます。供給液のメタノール成分は濃度45wt%であるので1000kg/h×0.45=450kg/hです。また、留出液は濃度99wt%なのでmD×0.99、同様に缶出液はmW×0.01なので成分物質収支は
450=0.99mD+0.01mW
です。この2式の連立方程式を解くとmD=449kg/h、mW=551kg/hとなります。
次にエネルギー収支の計算に入ります。まず⑧と⑨の蒸気量を求めます。
まず、供給液のエンタルピーH1
は供給量をmF(=1000kg/h)とすると、
H1=mFcpt1
ここで、水溶液の比熱cpはメタノールの比熱2.5kJ/(kg・℃)×濃度0.45+水の比熱4.2×濃度0.55から算出します。cは3.435kJ/(kg・℃)となります。
【仕様】1)で温度20℃で供給量1000kg/hなのでH1=1000×3.435×20=68700kJ/hとなります。
予熱器HE-1で加熱された供給液②のエンタルピーH②は【仕様】5)で温度75℃なので、1000×3.435×75=257625kJ/hとなります。
したがってエネルギー収支式は、HE-1での交換熱量をQ1とすると、
H1+Q1=H②
一方蒸気⑧は流量m8、比エンタルピーh⑧で流入し交換熱量-QHE-1により冷却、hドレンとなるのでエネルギー収支式は
m⑧h⑧+(-Q1)=m⑧hドレン
と表され、式変形するとm⑧=QHE-1/(h⑧-hドレン)
となります。また、供給液のエネルギー収支式から
Q①=H2-H①
なので
m⑧=(H②-H①)/(h⑧-hドレン)
となります。ここで、蒸気⑧の比エンタルピーは【仕様】6)で2.0atmとあるので蒸気表よりh8=2717kJ/kg、ドレンは2.0atmの飽和液とすると蒸気の比エンタルピーからその蒸気の蒸発潜熱λ分を差し引いたものがドレンの比エンタルピーということになるので、この場合の蒸気とドレンの比エンタルピー差h8-hドレン=λであり、蒸気表から2300kJ/kgなので蒸気流量は
m8=(257625-68700)/2300=84kg/hとなります。
一方、蒸気⑨も同様にm9=QHE-2/2300です。
ここで、QHE-2はリボイラー(HE-2)部分のエネルギー収支式を考えることになるのですが、その前にまず蒸留塔における物質の流れについてはっきりさせておくと少しは分かりやすくなりますかね。
ということで、蒸留塔におけるモル流量の量的関係を表す下図を作りましたので、これを使って考えていきましょうか。

これから、蒸留塔に絡む物質収支、エネルギー収支の計算をしていくわけですが、大きな違いは物質収支において今までやってきた質量流量ではなく、モル流量というもので考えるということです。これに伴いエネルギー収支を考える際も、これまでの比熱、蒸発潜熱からモル比熱、モル蒸発潜熱に換算して考えることになります。ではなぜそのような換算をする必要があるのか、それを図の説明に絡めてこれからしていきます。
図において供給液量F、流出液量D、缶出液量W、L、L*、V、V*はモル流量[kmol/h]でx、yはメタノールのモル分率[kmolメタノール/kmol]でRは還流比[-]です。破線は蒸留塔を表します。矢印は物質の移動方向、矢印の太さはモル流量を表します。図から、エタノールと水の組成は各段でだんだん変っていきますが、その混合液のモル流量自体は一定になっていることが分かりますでしょうか。これを等モル流れと言います。蒸留塔内ではこの等モル流れが起こっていると仮定して考えるのが一般的です。この等モル流れの関係を使うと計算がとても楽にできます。なので、蒸留塔に関する収支式の計算はモル流量で考えるということになります。
では、各モル流量はどのようにして求められるのでしょうか。
L、L*、V、V*の値はF、D、Wにより図の量的関係から求められます。
そして、F、D、Wは、それぞれ質量流量と濃度から求めたメタノール分[kg/h]÷メタノールの分子量[kg/kmol]+水分[kg/h]÷水の分子量[kg/kmol]で算出します。
またあとで、数値の算出過程で詳しく解説しますので、とりあえずエネルギー収支の計算を始めましょう。
図をみると、n+m+2段とあるところから缶出液Wがリボイラーにモル流量L*[kmol/h]、そのエンタルピーHL*[kJ/h]で流入し、熱量QHE-2[kJ/h]の加熱を受け、モル流量V*[kmol/h]の蒸気、そのエンタルピーHV*[kJ/h]とモル流量W[kmol/h]の缶出液、そのエンタルピーHW[kJ/h]で流出しています。
これをエネルギー収支式で表してみましょう。
HL*+QHE-2=HV*+HW
ということになります。これを式変形して、
QHE-2=HV*-HL*+HW
では、HV*、HL*、HWは何かということになりますが、ここでモル比熱、モル蒸発潜熱が出てきます。上記のエンタルピーをモル流量、モル比熱、モル蒸発潜熱で表してみましょう。エンタルピー=質量流量×比エンタルピー=モル流量×モルエンタルピーというふうに形が変わっただけなので本編1で述べた比エンタルピーの式と同様に考えると、まずモル流量V*[kmol/h]の蒸気のモルエンタルピーhV*,m[kJ/kmol]は、缶出液のモル比熱cW,m[kJ/kmol・℃]とその沸点の温度、つまり缶出液の温度tW[℃]、及び缶出液のモル蒸発潜熱λW,m[kJ/kmol]を使って、
hV*,m=cW,mtW+λW,m
なので、そのエンタルピーは
HV*=V*hV*,m=V*(cW,mtW+λW,m)
となります。
次、モル流量L*[kmol/h]の液体の比エンタルピーhL*,m[kJ/kmol]は、缶出液のモル比熱cW,m[kJ/kmol・℃]とその沸点の温度、つまり缶出液の温度tW[℃]を使って、
hL*,m=cW,mtW
なので、そのエンタルピーは
HL*=L*hL*,m=L*(cW,mtW)
となります。
また、モル流量W[kmol/h]の缶出液の比エンタルピーhW*,m[kJ/kmol]も、液体なので上記と同じで、
hW*,m=cW,mtW
なので、そのエンタルピーは
HW*=W*hW*,m=W*(cW,mtW)
となります。
こうして求めた各エンタルピーHV*、HL*、HW*を熱量QHE-2を求める式に代入すると、
QHE-2=HV*-HL*+HW
=V*(cW,mtW+λW,m)-L*(cW,mtW)+W*(cW,mtW)
=(V*-L*+W*)cW,mtW+V*λW,m
ここで、図の量的関係から、V*-L*+W*=0となるので上式は、第2項が残り
QHE-2=V*λW,m
また、図の量的関係から還流比Rを使って、V*=(R+1)Dと表せるので上式は、
QHE-2=(R+1)DλW,m
となります。後は数値計算で、リボイラーの熱量QHE-2[kJ/h]が求められます。
さて、次にコンデンサーの冷却量QHE-3[kJ/h]を求めてみましょう。図をみると、蒸留塔を出た留出液⑤はエタノール蒸気で、エンタルピーは
H⑤=V(cD,mt⑤+λD,m)
と表されます。
そして、HE-3コンデンサで冷却後のエンタルピーH⑤’とすると
H⑤’=VcD,mt④
と表されます。
冷却量をQHE-3とすると、エネルギー収支式は
H⑤-QHE-3=H⑤’
これを式変形して
QHE-3=H⑤-H⑤’=V(cD,m(t⑤-t④)+λD,m)
と表されます。
ここで、t⑤、λD,mはエタノールの常圧蒸気の物性値表より、t⑤= 、λD,m= ですが、t④に関しては求める必要があります。
そこで改めて蒸留塔のエネルギー収支式を考えてみます。すると図のような入出量関係があります。
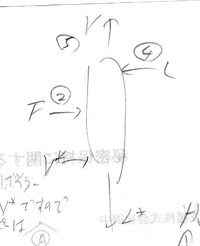
これをエネルギー収支式で表すと、まず流入しているのは②の供給液F、④の還流液L、リボイラーからの蒸気V*ですので、それぞれのエンタルピーは
②の供給液F;H②、④の還流液;H④、リボイラーからの蒸気V*;HV*
と表すと
(流入量)=H②+H④+HV*
と表せます。
一方、流出しているのは⑤の塔頂部からの蒸気V、塔底からリボイラーへ流下する液L*ですのでそれぞれのエンタルピーは
⑤の塔頂部からの蒸気V;H⑤、塔底からリボイラーへ流下する液L*;HL*
と表すと
(流出量)=H⑤+HL*
と表せます。
従って、(流入量)=(流出量)ですので
H②+H④+HV*= H⑤+HL*
これを式変形すると
H④= H⑤-H②-(HV*-HL*)
となります。
また、エンタルピーH④、H②をモル流量、モル比熱、温度で表すと
H④=LcD,mt④、H②=FcF,mt②
です。さらに図より、

HL*+QHE-2= HV*+H⑦
これを式変形し
HV*-HL*= QHE-2-H⑦
として、H⑦=WcW,mt⑦を代入すると、HV*-HL*= QHE-2-WcW,mt⑦
となり、これらをH④=H⑤-H②-(HV*-HL*)に代入すると
LcD,mt④= V(cD,mt⑤+λD,m)-FcF,mt②-(QHE-2-WcW,mt⑦)
となり、t④を求めると
t④=V/L(t⑤+λD,m/cD,m)-(FcF,m/LcD,m)t②-(QHE-2-WcW,mt⑦)/ LcD,m
となります。
1段とあるところから留出液Dの蒸気がモル流量V[kmol/h]、そのエンタルピーHV[kJ/h]で流入し、冷却量QHE-3[kJ/h]の冷却を受け、モル流量L[kmol/h]、そのエンタルピーHL[kJ/h]の液体で1段へと流下、もうひとつはモル流量D[kmol/h]、そのエンタルピーHD[kJ/h]の留出液Dが流出していきます。この留出液が供給液から分離精製されたエタノールということです。
これをエネルギー収支式で表してみましょう。
HV+(-QHE-3)=HL+HD
となります。今回は、冷却なので(-QHE-3)と負号を付けました。
さて、式でHV[kJ/h]とHL[kJ/h]が分かりにくいので別の形にしてみましょう。別の形で表したいHV[kJ/h]とHL[kJ/h]、また、リボイラーの熱量のところでモルエンタルピーで表したHV*、HL*、この両者が入った式があれば良いことになります。それは、蒸留塔全体でのエネルギー収支式です。図をみると蒸留塔を表す破線の枠内に入るのはまず供給液F、そして還流液L、リボイラーで加熱され蒸気として流入するV*の3流体、一方、出て行くのは1段から発生する蒸気V、n+m+2段から流下する液体L*の2流体ということになります。なので、これをエネルギー収支式で表すと、
HF+HL+HV*=HV+HL*
となります。ここで、リボイラーでのエネルギー収支式の関係から、HL*=HV*+HW-QHE-2と表せるので、これを上式に代入するとHV*がキャンセルされ、
HF+HL=HV+HW-QHE-2
となります。
この式に、コンデンサーのエネルギー収支式を式変形した、HV=HL+HD+QHE-3を代入すると、HLがキャンセルされ、
HF=HD+HW+QHE-3-QHE-2
となります。式変形すると
となり、ここに各数値HF;kJ/h、HD;kJ/h、HW;kJ/h、QHE-2;kJ/hを代入すると
QHE=
と求まりました。
さて、ここまでエンタルピー、熱量を求めてきましたが、ここで還流液④の温度t④を求めておきましょう。
なぜかというとt④は、後で詳しくやりますが、HE-3の熱交換器に供給する冷却水量を求める際に必要だがらです。
では、t④はどのような式で表されるでしょう。
還流液④のエンタルピーHLをt④などを使って表すと
となります。式変形して
となります。ここで、
HL=
また、
HV=kJ/h、、を代入すると
HL=kJ/hとなります。従って、t④の式にHL;kJ/h、、を代入すると
t④
=℃
となりました。
また、ここで質量流量に変わりモル流量で考えるにあたり、モル分率、モル比熱、モル蒸発潜熱も算出しておきましょう。これらは、蒸留に関する計算でよく使う数値なので基本的にはあらかじめ算出しておけばいいかと思います。
先に計算結果を示しておきます。
では計算の手順についてですが、モル流量→モル分率→モル比熱・モル蒸発潜熱という流れで行います。
まず、質量流量を元にしたモル流量への変換について、留出液Dを例に考えてみましょう。
流出液Dのモル流量Dをその成分であるエタノールと水のモル流量それぞれDエタノール、D水に分けます。
式で表すと、D=Dエタノール+D水ということです。
そして、各成分は各質量流量[kg/h]mD,エタノール、mD,水と各質量数[kg/kmol]
Mエタノール、
M水
で表すとDエタノール=mD,エタノール÷Mエタノール、D水=mD,水÷M水という関係です。
また、mD,水=mD-mD,エタノールと表せるので、これを代入して、D水=(mD-mD,エタノール÷M水となりますよね。
で、あとはmD,エタノールは留出液Dの濃度が99%という条件と物質収支の計算で求めたmD;449kg/hであることから数値計算は
mD,エタノール=mD×99/100=449×99/100=444.51kg/hなので、これと上記表に記載の水の物性値M水;18.02kg/kmolを代入し
D水=(mD-mD,エタノール)÷M水=(449-444.51)÷18.02=
また、Dエタノールに関しては、Mエタノール;32.04kg/kmolなので、
Dエタノール=mD,エタノール÷Mエタノール=444.51÷32.04=
従って、
D=Dエタノール+D水=
と出ました。
缶出液Wも同様にmW;、濃度1%の条件で計算するとWエタノール;、W;と出ました。
供給液Fは、
F=D+W=
となります。
これでモル流量は出そろいました。
次に、エタノールのモル分率xD、xWは、D、Wそれぞれの混合液のモル流量に対するそれぞれに含まれるエタノールのモル流量の割合のことを言います。
上述で出したDエタノール、Wエタノールより
xD=Dエタノール÷D=(%)、xW=Wエタノール÷W=(%)となります。
混合液のモル蒸発潜熱λm[kJ/kmol]は、エタノールのモル蒸発潜熱λエタノール,m、水のモル蒸発潜熱λ水,m、モル分率xから
λm=xλエタノール,m+(1-x)λ水,m
と表せます。つまり、混合液全体を1としてエタノールのモル蒸発潜熱にエタノール成分の割合であるモル分率をかけたものが、混合液1kg中に含まれるエタノールの蒸発に必要な熱量で、混合液1kg中の残りの成分である水の蒸発に必要な熱量として、水のモル蒸発潜熱λ水,mに水成分の割合である水のモル分率(1-x)をかけた分の熱量(1-x)λ水,mが必要で、混合液1kg全体では、その蒸発に必要な熱量はその合計ということです。
モル蒸発潜熱λm[kJ/kmol]は蒸発潜熱λ[kJ/kg]と質量数M[kg/kmol]から
λm=Mλ
という関係式で表されます。従って、エタノール、水のモル蒸発潜熱はそれぞれ
λエタノール,m=Mエタノールλエタノール、λ水,m=M水λ水
となります。Mエタノールはモル流量でも使った32.04kg/kmol、エタノールの蒸発潜熱は物性値の表に記載のλエタノール;1.1×10⁶J/kg=1100kJ/kg、水も同様にM水;18.02kg/kmol、λ水;2.3×10⁶J/kg=2300kJ/kgを使うと
λエタノール,m=18.02×1100=
λ水,m=32.04×2300=
となります。
従って、λm=xλエタノール,m+(1-x)λ水,m=
となり、ここに留出液ではxDを、缶出液ではxWの値を代入すると、
留出液のモル蒸発潜熱λD,m=
缶出液のモル蒸発潜熱λW,m=
と算出されました。
次にモル比熱について計算していきますが、モル比熱cp,m[kJ/kmol・K]も蒸発潜熱と同様、cp,m=cpMという関係式になるので、エタノール、水のモル比熱はそれぞれ
cp,エタノール,m=cp,エタノールMエタノール
cp,水,m=cp,水M水
それでは再び、各物性値を表で確認しましょうか。まず、エタノールの比熱が2.5×10³J/kg・K=2.5kJ/kg・K、水が4.2×10³J/kg・K=4.2kJ/kg・K、先程から何度も出てきた物質量はMエタノール;32.04kg/kmol、M水;18.02kg/kmolなので、それぞれ代入し、
cp,エタノール,m=2.5×32.04=
cp,水,m=4.2×18.02=
混合液のモル比熱も蒸発潜熱のときと同様、
cp,m=xcp,エタノール,m+(1-x)cp,水,m
と表され、cp,エタノール,m;、cp,水,m;を代入し、
cp,m=
となります。ここに留出液はxDを、缶出液はxWの数値を代入すると、
留出液のモル比熱cp,D,m=
缶出液のモル比熱cp,W,m=
と算出されました。
さて、数値の準備ができたので、エネルギー収支の計算に入りましょう。
mD,エタノールiwocp,mをモル比熱[kJ/(kmol・℃]、λmをモル蒸発潜熱[kJ/(kmol・℃]とすると
HV*=V*(cpW,mtw+λW,m)
HL*=L*cp,mtw
HW=WcpW,mtw
と表され、これらをリボイラー部分のエネルギー収支式を式変形したQHE-2=HV*+HW-HL*に代入すると
QHE-2=V*(cp,mtw+λm)+WcpW,mtw-L*cpW,mtw
=(V*+W-L*)cpW,mtw+V*λW,m)
=V*λW,m
図から、V*=V=(R+1)D、
上式のモル流量は質量流量×モル数、モル蒸発潜熱は質量流量、蒸発潜熱の関係に換算すると還流比Rを用いて
V*λW,m=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)
となります。これは図をみると計算しなくても一目瞭然です。
この式の根拠は、まずV*をR、Dで表します。図からV*=L*-W=L+F-W=RD+F-W、F-W=Dを代入し、RD+D=(R+1)Dとなります。
mDの99wt%がメタノール分でそれをメタノールの分子量Mメタノールで割ったメタノール分のモル流量と、1%の水分を水の分子量M水で割った水分のモル流量の和
D=0.99mD/Mメタノール+0.01mD/M水=mD(0.99/Mメタノール+0.01/M水)
となり、これをV*に代入すると
V*=(R+1)mD(0.99/Mメタノール+0.01/M水)
となります。
一方、モル蒸発潜熱λW,mを蒸発潜熱λWとメタノール水溶液1kgの分子量Mで表します。
λW,m=λWM
となります。缶出液W1kgのメタノールの物質量(モル数)は0.01[kg-メタノール/kg]/Mメタノール[kgメタノール/kmol-メタノール]=0.01/Mメタノール[kmol-メタノール/kg]、同様に、水の物質量は0.99/M水[kmol-水/kg]なので缶出液W1kgの物質量は、0.01/Mメタノール+0.99/M水[kmol/kg]となります。従って、メタノール水溶液1kmolの質量、つまり分子量Mは上式の逆数1/(0.01/Mメタノール+0.99/M水)となります。
これをλW,m=λWMに代入すると
λW,m=λW/(0.01/Mメタノール+0.99/M水)
となります。この式とV*=(R+1)mD(0.99/Mメタノール+0.01/M水)をモル流量×モル蒸発潜熱V*λW,mに代入すると
(R+1)mD(0.99/Mメタノール+0.01/M水)×λW/(0.01/Mメタノール+0.99/M水)=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)
とります。以上がモル流量×モル蒸発潜熱を質量流量×蒸発潜熱の関係式の根拠です。
次に、メタノール水溶液の蒸発潜熱λWの値ですが、比熱の場合と同様にメタノール分×メタノールの蒸発潜熱+水分×水の蒸発潜熱として求めると0.01×1100+0.99×2300=2288kJ/kgとなります。また、Mメタノール/M水=32.04/18.02=1.778、還流比Rは【仕様】4)より1.25、mD=449kg/hと数値が出揃ったのでこれをQHE-2=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)に代入すると
QHE-2=(1.25+1)×449×2288×(99+1.778)÷(99×1.778+1)=1315884kJ/h
従って、蒸気⑨はm9=QHE-2/2300=1315884÷2300=572kg/h
さて、前回、蒸気、溶液の比熱について説明しましたが、蒸気に関して補足資料として飽和水蒸気表を紹介します。
この表、特に飽和蒸気表1をプロセスの計算でも使います。
飽和水蒸気表は水の各圧力における飽和温度、飽和蒸気の比エンタルピー、蒸発潜熱などが記載されており0℃の液体の状態を比エンタルピーの基準(0kcal/kg)としています。飽和水蒸気表1では0℃の値が記載されていませんが飽和水蒸気表2(出典 新版 化学工学 -解説と演習- (2000))では温度t=0℃のときの比エンタルピーが2502kJ/kg、蒸発潜熱が2502kJ/kgとあることから比エンタルピーから蒸発潜熱を差し引いた飽和液の比エンタルピーが0になっていることがわかります。また、表の単位が1と2で異なりますが1kcal=4.186kJとして換算すると同じような値になっていることが確認できます。また、圧力の単位kg/cm2≒atmとして問題ありません。


飽和水蒸気表1 飽和水蒸気表2
また、今回のプロセスの計算に必要なメタノール、水の各物性値を掲載します。

プロセスの設計ではまず、物質収支を考えます。物質収支とは物質の入量=出量という物質量保存則のことで、全物質収支と成分物質収支の式を立て、それらの連立方程式を解きます。
【仕様】1)で供給液①は濃度45wt%と供給量1000kg/hが設定され、2)で留出液⑥の濃度99wt%、3)で缶出液⑦の濃度1wt%という製品側の条件が設定されています。するとこれらの条件から留出液、缶出液の量が計算できます。(wt%は質量パーセント濃度)
メタノール水溶液の物質収支は留出液の量mD、缶出液の量mWとすると全物質収支は
1000=mD+mW
一方、メタノールの成分物質収支は水溶液のメタノール成分の量について考えます。供給液のメタノール成分は濃度45wt%であるので1000kg/h×0.45=450kg/hです。また、留出液は濃度99wt%なのでmD×0.99、同様に缶出液はmW×0.01なので成分物質収支は
450=0.99mD+0.01mW
です。この2式の連立方程式を解くとmD=449kg/h、mW=551kg/hとなります。
次にエネルギー収支の計算に入ります。まず⑧と⑨の蒸気量を求めます。
まず、供給液のエンタルピーH1
は供給量をmF(=1000kg/h)とすると、
H1=mFcpt1
ここで、水溶液の比熱cpはメタノールの比熱2.5kJ/(kg・℃)×濃度0.45+水の比熱4.2×濃度0.55から算出します。cは3.435kJ/(kg・℃)となります。
【仕様】1)で温度20℃で供給量1000kg/hなのでH1=1000×3.435×20=68700kJ/hとなります。
予熱器HE-1で加熱された供給液②のエンタルピーH②は【仕様】5)で温度75℃なので、1000×3.435×75=257625kJ/hとなります。
したがってエネルギー収支式は、HE-1での交換熱量をQ1とすると、
H1+Q1=H②
一方蒸気⑧は流量m8、比エンタルピーh⑧で流入し交換熱量-QHE-1により冷却、hドレンとなるのでエネルギー収支式は
m⑧h⑧+(-Q1)=m⑧hドレン
と表され、式変形するとm⑧=QHE-1/(h⑧-hドレン)
となります。また、供給液のエネルギー収支式から
Q①=H2-H①
なので
m⑧=(H②-H①)/(h⑧-hドレン)
となります。ここで、蒸気⑧の比エンタルピーは【仕様】6)で2.0atmとあるので蒸気表よりh8=2717kJ/kg、ドレンは2.0atmの飽和液とすると蒸気の比エンタルピーからその蒸気の蒸発潜熱λ分を差し引いたものがドレンの比エンタルピーということになるので、この場合の蒸気とドレンの比エンタルピー差h8-hドレン=λであり、蒸気表から2300kJ/kgなので蒸気流量は
m8=(257625-68700)/2300=84kg/hとなります。
一方、蒸気⑨も同様にm9=QHE-2/2300です。
ここで、QHE-2はリボイラー(HE-2)部分のエネルギー収支式を考えることになるのですが、その前にまず蒸留塔における物質の流れについてはっきりさせておくと少しは分かりやすくなりますかね。
ということで、蒸留塔におけるモル流量の量的関係を表す下図を作りましたので、これを使って考えていきましょうか。

これから、蒸留塔に絡む物質収支、エネルギー収支の計算をしていくわけですが、大きな違いは物質収支において今までやってきた質量流量ではなく、モル流量というもので考えるということです。これに伴いエネルギー収支を考える際も、これまでの比熱、蒸発潜熱からモル比熱、モル蒸発潜熱に換算して考えることになります。ではなぜそのような換算をする必要があるのか、それを図の説明に絡めてこれからしていきます。
図において供給液量F、流出液量D、缶出液量W、L、L*、V、V*はモル流量[kmol/h]でx、yはメタノールのモル分率[kmolメタノール/kmol]でRは還流比[-]です。破線は蒸留塔を表します。矢印は物質の移動方向、矢印の太さはモル流量を表します。図から、エタノールと水の組成は各段でだんだん変っていきますが、その混合液のモル流量自体は一定になっていることが分かりますでしょうか。これを等モル流れと言います。蒸留塔内ではこの等モル流れが起こっていると仮定して考えるのが一般的です。この等モル流れの関係を使うと計算がとても楽にできます。なので、蒸留塔に関する収支式の計算はモル流量で考えるということになります。
では、各モル流量はどのようにして求められるのでしょうか。
L、L*、V、V*の値はF、D、Wにより図の量的関係から求められます。
そして、F、D、Wは、それぞれ質量流量と濃度から求めたメタノール分[kg/h]÷メタノールの分子量[kg/kmol]+水分[kg/h]÷水の分子量[kg/kmol]で算出します。
またあとで、数値の算出過程で詳しく解説しますので、とりあえずエネルギー収支の計算を始めましょう。
図をみると、n+m+2段とあるところから缶出液Wがリボイラーにモル流量L*[kmol/h]、そのエンタルピーHL*[kJ/h]で流入し、熱量QHE-2[kJ/h]の加熱を受け、モル流量V*[kmol/h]の蒸気、そのエンタルピーHV*[kJ/h]とモル流量W[kmol/h]の缶出液、そのエンタルピーHW[kJ/h]で流出しています。
これをエネルギー収支式で表してみましょう。
HL*+QHE-2=HV*+HW
ということになります。これを式変形して、
QHE-2=HV*-HL*+HW
では、HV*、HL*、HWは何かということになりますが、ここでモル比熱、モル蒸発潜熱が出てきます。上記のエンタルピーをモル流量、モル比熱、モル蒸発潜熱で表してみましょう。エンタルピー=質量流量×比エンタルピー=モル流量×モルエンタルピーというふうに形が変わっただけなので本編1で述べた比エンタルピーの式と同様に考えると、まずモル流量V*[kmol/h]の蒸気のモルエンタルピーhV*,m[kJ/kmol]は、缶出液のモル比熱cW,m[kJ/kmol・℃]とその沸点の温度、つまり缶出液の温度tW[℃]、及び缶出液のモル蒸発潜熱λW,m[kJ/kmol]を使って、
hV*,m=cW,mtW+λW,m
なので、そのエンタルピーは
HV*=V*hV*,m=V*(cW,mtW+λW,m)
となります。
次、モル流量L*[kmol/h]の液体の比エンタルピーhL*,m[kJ/kmol]は、缶出液のモル比熱cW,m[kJ/kmol・℃]とその沸点の温度、つまり缶出液の温度tW[℃]を使って、
hL*,m=cW,mtW
なので、そのエンタルピーは
HL*=L*hL*,m=L*(cW,mtW)
となります。
また、モル流量W[kmol/h]の缶出液の比エンタルピーhW*,m[kJ/kmol]も、液体なので上記と同じで、
hW*,m=cW,mtW
なので、そのエンタルピーは
HW*=W*hW*,m=W*(cW,mtW)
となります。
こうして求めた各エンタルピーHV*、HL*、HW*を熱量QHE-2を求める式に代入すると、
QHE-2=HV*-HL*+HW
=V*(cW,mtW+λW,m)-L*(cW,mtW)+W*(cW,mtW)
=(V*-L*+W*)cW,mtW+V*λW,m
ここで、図の量的関係から、V*-L*+W*=0となるので上式は、第2項が残り
QHE-2=V*λW,m
また、図の量的関係から還流比Rを使って、V*=(R+1)Dと表せるので上式は、
QHE-2=(R+1)DλW,m
となります。後は数値計算で、リボイラーの熱量QHE-2[kJ/h]が求められます。
さて、次にコンデンサーの冷却量QHE-3[kJ/h]を求めてみましょう。図をみると、蒸留塔を出た留出液⑤はエタノール蒸気で、エンタルピーは
H⑤=V(cD,mt⑤+λD,m)
と表されます。
そして、HE-3コンデンサで冷却後のエンタルピーH⑤’とすると
H⑤’=VcD,mt④
と表されます。
冷却量をQHE-3とすると、エネルギー収支式は
H⑤-QHE-3=H⑤’
これを式変形して
QHE-3=H⑤-H⑤’=V(cD,m(t⑤-t④)+λD,m)
と表されます。
ここで、t⑤、λD,mはエタノールの常圧蒸気の物性値表より、t⑤= 、λD,m= ですが、t④に関しては求める必要があります。
そこで改めて蒸留塔のエネルギー収支式を考えてみます。すると図のような入出量関係があります。

これをエネルギー収支式で表すと、まず流入しているのは②の供給液F、④の還流液L、リボイラーからの蒸気V*ですので、それぞれのエンタルピーは
②の供給液F;H②、④の還流液;H④、リボイラーからの蒸気V*;HV*
と表すと
(流入量)=H②+H④+HV*
と表せます。
一方、流出しているのは⑤の塔頂部からの蒸気V、塔底からリボイラーへ流下する液L*ですのでそれぞれのエンタルピーは
⑤の塔頂部からの蒸気V;H⑤、塔底からリボイラーへ流下する液L*;HL*
と表すと
(流出量)=H⑤+HL*
と表せます。
従って、(流入量)=(流出量)ですので
H②+H④+HV*= H⑤+HL*
これを式変形すると
H④= H⑤-H②-(HV*-HL*)
となります。
また、エンタルピーH④、H②をモル流量、モル比熱、温度で表すと
H④=LcD,mt④、H②=FcF,mt②
です。さらに図より、

HL*+QHE-2= HV*+H⑦
これを式変形し
HV*-HL*= QHE-2-H⑦
として、H⑦=WcW,mt⑦を代入すると、HV*-HL*= QHE-2-WcW,mt⑦
となり、これらをH④=H⑤-H②-(HV*-HL*)に代入すると
LcD,mt④= V(cD,mt⑤+λD,m)-FcF,mt②-(QHE-2-WcW,mt⑦)
となり、t④を求めると
t④=V/L(t⑤+λD,m/cD,m)-(FcF,m/LcD,m)t②-(QHE-2-WcW,mt⑦)/ LcD,m
となります。
1段とあるところから留出液Dの蒸気がモル流量V[kmol/h]、そのエンタルピーHV[kJ/h]で流入し、冷却量QHE-3[kJ/h]の冷却を受け、モル流量L[kmol/h]、そのエンタルピーHL[kJ/h]の液体で1段へと流下、もうひとつはモル流量D[kmol/h]、そのエンタルピーHD[kJ/h]の留出液Dが流出していきます。この留出液が供給液から分離精製されたエタノールということです。
これをエネルギー収支式で表してみましょう。
HV+(-QHE-3)=HL+HD
となります。今回は、冷却なので(-QHE-3)と負号を付けました。
さて、式でHV[kJ/h]とHL[kJ/h]が分かりにくいので別の形にしてみましょう。別の形で表したいHV[kJ/h]とHL[kJ/h]、また、リボイラーの熱量のところでモルエンタルピーで表したHV*、HL*、この両者が入った式があれば良いことになります。それは、蒸留塔全体でのエネルギー収支式です。図をみると蒸留塔を表す破線の枠内に入るのはまず供給液F、そして還流液L、リボイラーで加熱され蒸気として流入するV*の3流体、一方、出て行くのは1段から発生する蒸気V、n+m+2段から流下する液体L*の2流体ということになります。なので、これをエネルギー収支式で表すと、
HF+HL+HV*=HV+HL*
となります。ここで、リボイラーでのエネルギー収支式の関係から、HL*=HV*+HW-QHE-2と表せるので、これを上式に代入するとHV*がキャンセルされ、
HF+HL=HV+HW-QHE-2
となります。
この式に、コンデンサーのエネルギー収支式を式変形した、HV=HL+HD+QHE-3を代入すると、HLがキャンセルされ、
HF=HD+HW+QHE-3-QHE-2
となります。式変形すると
となり、ここに各数値HF;kJ/h、HD;kJ/h、HW;kJ/h、QHE-2;kJ/hを代入すると
QHE=
と求まりました。
さて、ここまでエンタルピー、熱量を求めてきましたが、ここで還流液④の温度t④を求めておきましょう。
なぜかというとt④は、後で詳しくやりますが、HE-3の熱交換器に供給する冷却水量を求める際に必要だがらです。
では、t④はどのような式で表されるでしょう。
還流液④のエンタルピーHLをt④などを使って表すと
となります。式変形して
となります。ここで、
HL=
また、
HV=kJ/h、、を代入すると
HL=kJ/hとなります。従って、t④の式にHL;kJ/h、、を代入すると
t④
=℃
となりました。
また、ここで質量流量に変わりモル流量で考えるにあたり、モル分率、モル比熱、モル蒸発潜熱も算出しておきましょう。これらは、蒸留に関する計算でよく使う数値なので基本的にはあらかじめ算出しておけばいいかと思います。
先に計算結果を示しておきます。
では計算の手順についてですが、モル流量→モル分率→モル比熱・モル蒸発潜熱という流れで行います。
まず、質量流量を元にしたモル流量への変換について、留出液Dを例に考えてみましょう。
流出液Dのモル流量Dをその成分であるエタノールと水のモル流量それぞれDエタノール、D水に分けます。
式で表すと、D=Dエタノール+D水ということです。
そして、各成分は各質量流量[kg/h]mD,エタノール、mD,水と各質量数[kg/kmol]
Mエタノール、
M水
で表すとDエタノール=mD,エタノール÷Mエタノール、D水=mD,水÷M水という関係です。
また、mD,水=mD-mD,エタノールと表せるので、これを代入して、D水=(mD-mD,エタノール÷M水となりますよね。
で、あとはmD,エタノールは留出液Dの濃度が99%という条件と物質収支の計算で求めたmD;449kg/hであることから数値計算は
mD,エタノール=mD×99/100=449×99/100=444.51kg/hなので、これと上記表に記載の水の物性値M水;18.02kg/kmolを代入し
D水=(mD-mD,エタノール)÷M水=(449-444.51)÷18.02=
また、Dエタノールに関しては、Mエタノール;32.04kg/kmolなので、
Dエタノール=mD,エタノール÷Mエタノール=444.51÷32.04=
従って、
D=Dエタノール+D水=
と出ました。
缶出液Wも同様にmW;、濃度1%の条件で計算するとWエタノール;、W;と出ました。
供給液Fは、
F=D+W=
となります。
これでモル流量は出そろいました。
次に、エタノールのモル分率xD、xWは、D、Wそれぞれの混合液のモル流量に対するそれぞれに含まれるエタノールのモル流量の割合のことを言います。
上述で出したDエタノール、Wエタノールより
xD=Dエタノール÷D=(%)、xW=Wエタノール÷W=(%)となります。
混合液のモル蒸発潜熱λm[kJ/kmol]は、エタノールのモル蒸発潜熱λエタノール,m、水のモル蒸発潜熱λ水,m、モル分率xから
λm=xλエタノール,m+(1-x)λ水,m
と表せます。つまり、混合液全体を1としてエタノールのモル蒸発潜熱にエタノール成分の割合であるモル分率をかけたものが、混合液1kg中に含まれるエタノールの蒸発に必要な熱量で、混合液1kg中の残りの成分である水の蒸発に必要な熱量として、水のモル蒸発潜熱λ水,mに水成分の割合である水のモル分率(1-x)をかけた分の熱量(1-x)λ水,mが必要で、混合液1kg全体では、その蒸発に必要な熱量はその合計ということです。
モル蒸発潜熱λm[kJ/kmol]は蒸発潜熱λ[kJ/kg]と質量数M[kg/kmol]から
λm=Mλ
という関係式で表されます。従って、エタノール、水のモル蒸発潜熱はそれぞれ
λエタノール,m=Mエタノールλエタノール、λ水,m=M水λ水
となります。Mエタノールはモル流量でも使った32.04kg/kmol、エタノールの蒸発潜熱は物性値の表に記載のλエタノール;1.1×10⁶J/kg=1100kJ/kg、水も同様にM水;18.02kg/kmol、λ水;2.3×10⁶J/kg=2300kJ/kgを使うと
λエタノール,m=18.02×1100=
λ水,m=32.04×2300=
となります。
従って、λm=xλエタノール,m+(1-x)λ水,m=
となり、ここに留出液ではxDを、缶出液ではxWの値を代入すると、
留出液のモル蒸発潜熱λD,m=
缶出液のモル蒸発潜熱λW,m=
と算出されました。
次にモル比熱について計算していきますが、モル比熱cp,m[kJ/kmol・K]も蒸発潜熱と同様、cp,m=cpMという関係式になるので、エタノール、水のモル比熱はそれぞれ
cp,エタノール,m=cp,エタノールMエタノール
cp,水,m=cp,水M水
それでは再び、各物性値を表で確認しましょうか。まず、エタノールの比熱が2.5×10³J/kg・K=2.5kJ/kg・K、水が4.2×10³J/kg・K=4.2kJ/kg・K、先程から何度も出てきた物質量はMエタノール;32.04kg/kmol、M水;18.02kg/kmolなので、それぞれ代入し、
cp,エタノール,m=2.5×32.04=
cp,水,m=4.2×18.02=
混合液のモル比熱も蒸発潜熱のときと同様、
cp,m=xcp,エタノール,m+(1-x)cp,水,m
と表され、cp,エタノール,m;、cp,水,m;を代入し、
cp,m=
となります。ここに留出液はxDを、缶出液はxWの数値を代入すると、
留出液のモル比熱cp,D,m=
缶出液のモル比熱cp,W,m=
と算出されました。
さて、数値の準備ができたので、エネルギー収支の計算に入りましょう。
mD,エタノールiwocp,mをモル比熱[kJ/(kmol・℃]、λmをモル蒸発潜熱[kJ/(kmol・℃]とすると
HV*=V*(cpW,mtw+λW,m)
HL*=L*cp,mtw
HW=WcpW,mtw
と表され、これらをリボイラー部分のエネルギー収支式を式変形したQHE-2=HV*+HW-HL*に代入すると
QHE-2=V*(cp,mtw+λm)+WcpW,mtw-L*cpW,mtw
=(V*+W-L*)cpW,mtw+V*λW,m)
=V*λW,m
図から、V*=V=(R+1)D、
上式のモル流量は質量流量×モル数、モル蒸発潜熱は質量流量、蒸発潜熱の関係に換算すると還流比Rを用いて
V*λW,m=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)
となります。これは図をみると計算しなくても一目瞭然です。
この式の根拠は、まずV*をR、Dで表します。図からV*=L*-W=L+F-W=RD+F-W、F-W=Dを代入し、RD+D=(R+1)Dとなります。
mDの99wt%がメタノール分でそれをメタノールの分子量Mメタノールで割ったメタノール分のモル流量と、1%の水分を水の分子量M水で割った水分のモル流量の和
D=0.99mD/Mメタノール+0.01mD/M水=mD(0.99/Mメタノール+0.01/M水)
となり、これをV*に代入すると
V*=(R+1)mD(0.99/Mメタノール+0.01/M水)
となります。
一方、モル蒸発潜熱λW,mを蒸発潜熱λWとメタノール水溶液1kgの分子量Mで表します。
λW,m=λWM
となります。缶出液W1kgのメタノールの物質量(モル数)は0.01[kg-メタノール/kg]/Mメタノール[kgメタノール/kmol-メタノール]=0.01/Mメタノール[kmol-メタノール/kg]、同様に、水の物質量は0.99/M水[kmol-水/kg]なので缶出液W1kgの物質量は、0.01/Mメタノール+0.99/M水[kmol/kg]となります。従って、メタノール水溶液1kmolの質量、つまり分子量Mは上式の逆数1/(0.01/Mメタノール+0.99/M水)となります。
これをλW,m=λWMに代入すると
λW,m=λW/(0.01/Mメタノール+0.99/M水)
となります。この式とV*=(R+1)mD(0.99/Mメタノール+0.01/M水)をモル流量×モル蒸発潜熱V*λW,mに代入すると
(R+1)mD(0.99/Mメタノール+0.01/M水)×λW/(0.01/Mメタノール+0.99/M水)=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)
とります。以上がモル流量×モル蒸発潜熱を質量流量×蒸発潜熱の関係式の根拠です。
次に、メタノール水溶液の蒸発潜熱λWの値ですが、比熱の場合と同様にメタノール分×メタノールの蒸発潜熱+水分×水の蒸発潜熱として求めると0.01×1100+0.99×2300=2288kJ/kgとなります。また、Mメタノール/M水=32.04/18.02=1.778、還流比Rは【仕様】4)より1.25、mD=449kg/hと数値が出揃ったのでこれをQHE-2=(R+1)mDλW(99+Mメタノール/M水)/(99Mメタノール/M水+1)に代入すると
QHE-2=(1.25+1)×449×2288×(99+1.778)÷(99×1.778+1)=1315884kJ/h
従って、蒸気⑨はm9=QHE-2/2300=1315884÷2300=572kg/h
この記事へのトラックバックURL
http://kankyoushouene.mediacat-blog.jp/t106067
